Kalium disianoaurat
 | |
| Nama | |
|---|---|
| Nama IUPAC Kalium disianoaurat(I) | |
| Nama lain | |
| Penanda | |
Nomor CAS |
|
Model 3D (JSmol) |
|
| 3DMet | {{{3DMet}}} |
| Referensi Beilstein | 6235525 |
| ChEBI |
|
| ChemSpider |
|
| Nomor EC | |
| Referensi Gmelin | 37363 |
PubChem CID |
|
| Nomor RTECS | {{{value}}} |
| UNII |
|
| Nomor UN | 1588 |
CompTox Dashboard (EPA) |
|
InChI
| |
SMILES
| |
| Sifat | |
Rumus kimia | KAu(CN)2 |
| Massa molar | 288,101 g/mol |
| Penampilan | kristal putih[1] |
| Densitas | 3,45 g/cm3[1] |
| Titik didih | terurai |
Kelarutan dalam air | 140 g/L[1] |
| Struktur | |
Struktur kristal | Rombohedron, hR54, No. 148 |
| R3 | |
a = 0,728 nm, b = 0,728 nm, c = 2,636 nm | |
Volum kisi (V) | 1,2099 nm3 |
Satuan formula (Z) | 9 |
| Bahaya | |
| Bahaya utama | beracun |
| Piktogram GHS |    |
| Keterangan bahaya GHS | {{{value}}} |
| H290, H300, H310, H315, H317, H318, H330, H410 | |
| P260, P264, P273, P280, P284, P301+310 | |
| Senyawa terkait | |
Anion lain | Kalium argentosianida |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Kalium disianoaurat adalah sebuah senyawa anorganik dengan rumus K[Au(CN)2]. Ia adalah padatan tidak berwarna hingga putih yang larut dalam air dan sedikit larut dalam alkohol. Garam itu sendiri seringkali tidak diisolasi, tetapi larutan ion disianoaurat ([Au(CN)2]−) dihasilkan dalam skala besar dalam ekstraksi emas dari bijihnya.[3]
Produksi
Dalam penambangan emas dari sumber encer, emas diekstraksi secara selektif melalui disolusi dalam larutan sianida berair, disediakan dengan melarutkan natrium sianida, kalium sianida dan/atau kalsium sianida. Reaksi untuk disolusi emas, "Persamaan Elsner", adalah:
- 4 Au + 8 KCN + O2 + 2 H2O → 4 K[Au(CN)2] + 4 KOH
Dalam proses ini, oksigen adalah oksidannya.[4]
Ia juga dapat dihasilkan melalui reaksi garam emas(I) dengan kelebihan kalium sianida.
- AuCl + 2 KCN → K[Au(CN)2] + KCl
Struktur
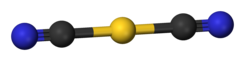
Disianoaurat adalah anion berbentuk batang.
Kalium disianoaurat adalah sebuah garam. Anion disianoaurat adalah linear menurut kristalografi sinar-X.[3] Berdasarkan spektroskopi inframerah, anion disianoaurat mengadopsi struktur yang sangat mirip dengan natrium disianoaurat (NaAu(CN)2).[5]
Kegunaan
Disianoaurat adalah spesies larut yang menjadi fokus sianidasi emas, proses hidrometalurgi untuk memisahkan emas dari bijih encer. Faktanya, natrium sianida, bukan garam kalium sianida, lebih banyak digunakan dalam proses komersial.[6]
Selain penggunaan utamanya sebagai perantara dalam ekstraksi emas, kalium disianoaurat sering digunakan dalam aplikasi penyepuhan emas.
Senyawa terkait
Senyawa yang mengandung emas(III) sianida juga telah dikenal: kalium tetrasianoaurat(III), K[Au(CN)4]. Penggunaannya kurang umum.
Ion kalium dapat diganti dengan kation amonium kuaterner seperti pada tetrabutilamonium disianoaurat.[7]
Keamanan
Menelan kalium disianoaurat dalam jumlah beberapa gram dapat menyebabkan kematian.[8]
Referensi
- ^ a b c d Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (edisi ke-92). CRC Press. hlm. 4.82. ISBN 978-1439855119.
- ^ Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (Edisi ke-2), Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
- ^ a b Rosenzweig, A.; Cromer, D. T. (1959). "The Crystal Structure of KAu(CN)2". Acta Crystallographica. 12 (10): 709–712. doi:10.1107/S0365110X59002109.
- ^ Treatment of Ores Containing Reactive Iron Sulphides. Multi Mix Systems
- ^ Chadwick, B.M.; Frankiss, S.G. (1976). "Vibrational Spectra and Structures of Some Dicyanoaurate(I) Complexes". Journal of Molecular Structure. 31 (1): 1–9. Bibcode:1976JMoSt..31....1C. doi:10.1016/0022-2860(76)80113-5.
- ^ Rubo, Andreas; Kellens, Raf; Reddy, Jay; Steier, Norbert; Hasenpusch, Wolfgang (2005), "Alkali Metal Cyanides", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.i01_i01
- ^ Stender, Matthias; Olmstead, Marilyn M.; Balch, Alan L.; Rios, Daniel; Attar, Saeed (2003). "Cation and Hydrogen Bonding Effects on the Self-Association and Luminescence of the Dicyanoaurate Ion, Au(CN)2−". Dalton Transactions (22): 4282. doi:10.1039/b310085e.
- ^ Wright, I. H.; Vesey, C. J. (September 1986). "Acute poisoning with gold cyanide". Anaesthesia. 41 (9): 936–939. doi:10.1111/j.1365-2044.1986.tb12920.x
 . PMID 3022615.
. PMID 3022615.










