フッ化スルフリル
| フッ化スルフリル | |
|---|---|
 | |
 | |
Sulfuryl fluoride | |
別称 スルフリルフルオライド スルホニルジフルオリド | |
| 識別情報 | |
| CAS登録番号 | 2699-79-8 |
| 特性 | |
| 化学式 | SO2F2 |
| モル質量 | 102.06 g/mol |
| 外観 | 無色の気体 |
| 密度 | 4.172 g/L (気体) 1.632 g/mL (0 °C、圧縮液化) |
| 融点 | -124.7 °C, 148.5 K |
| 沸点 | 7.1 °C, 280.3 K |
| 水への溶解度 | 難溶 |
| その他の溶媒への溶解度 | SO2 |
| 構造 | |
| 配位構造 | 四面体形 |
| 危険性 | |
| 主な危険性 | 毒性 |
| NFPA 704 |  0 3 1 |
| 関連する物質 | |
| 関連物質 | 塩化スルフリルSO2Cl2 六フッ化硫黄SF6, 三酸化硫黄SO3 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
フッ化スルフリル(フッかスルフリル、英: Sulfuryl fluoride)は、化学式SO2F2で表される無機化合物。
構造と性質
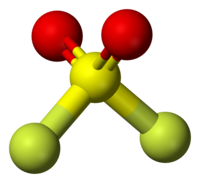
分子構造はC2v対称性を持つ左右対称の四面体形で、分子間の距離は硫黄-酸素間が140.5 pm、硫黄-フッ素間は150.3 pm。結合角度は酸素-硫黄-酸素が124°、フッ素-硫黄-フッ素が96°[1]。 二酸化硫黄とフッ素との直接反応により生成する。
実験室レベルでは、下記のように塩化フッ化スルフリルを経た多段階の合成により作られる[2]。
フルオロスルホン酸の金属塩の加熱によっても得ることができる。
用途

ダウ・ケミカルにより開発され、オゾン層を破壊する懸念のある臭化メチルに代わる燻蒸剤として、シロアリやキクイムシ、トコジラミなどの駆除に用いられる。
住宅の燻蒸には、建物全体を丈夫なテントで覆って密閉し、短い場合で16~18時間、最長で72時間、テント内部をフッ化スルフリルで充満させたのち、6時間換気する。燻蒸開始から換気が済むまでは人が立ち入ることはできないが、フッ化スルフリルは無色・無臭であるため、燻蒸開始時には確実に人が退去したか確認するため、刺激性のあるクロルピクリンをテント内に放出する。
安全性
日本の毒物及び劇物取締法では毒物に分類されている。ラットに経口投与した場合の半数致死量(LD50)は100 mg/kg、ラットに吸入させた場合の半数致死濃度(LC50、4時間)は雄で1865ppm、雌では1510ppm[3]。
摂取すると代謝性アシドーシス、低カルシウム血症、不整脈、肺浮腫や、中枢神経・腎臓・歯などに症状を生じる[4][5][6]。
救急処置としてカルシウムの補給、炭酸水素ナトリウムの投与、血液透析が行われる[4]。2006年には、埼玉県の博物館で害虫駆除に使われたフッ化スルフリルを吸入して、作業員が死亡する事故が起きている[7]。皮膚に対する腐食性・刺激性は確認されていない[3]が、圧縮液化されたものに触れると凍傷のおそれがある。
不燃性だが、加熱により分解し、フッ化水素や硫黄酸化物など有害ガスを生じる[8]。
環境への影響
マサチューセッツ工科大学の研究チームは、フッ化スルフリルが大気中に約36年にわたり残留し、二酸化炭素の4,800倍の温室効果を有すると報告した[9]。
脚注
- ^ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ^ Seel, F. "Potassium Fluorosulfite" Inorganic Syntheses 1967, IX, pages 113-115. doi:10.1002/9780470132401.ch29.
- ^ a b 製品安全データシート(安全衛生情報センター)
- ^ a b Schneir A, Clark RF, Kene M, Betten D (November 2008). “Systemic fluoride poisoning and death from inhalational exposure to sulfuryl fluoride”. Clin Toxicol (Phila) 46 (9): 850-4. PMID 18608259.
- ^ Centers for Disease Control (CDC) (Sep 18 1987). “Fatalities resulting from sulfuryl fluoride exposure after home fumigation--Virginia”. MMWR Morb Mortal Wkly Rep 36 (36): 602-4, 609-11. PMID 3114607.
- ^ Scheuerman EH (1986). “Suicide by exposure to sulfuryl fluoride”. J Forensic Sci 31 (3): 1154-8. PMID 3734735.
- ^ 埼玉県立歴史と民俗の博物館
- ^ 国際化学物質安全性カード
- ^ 2009年3月25日付日刊温暖化新聞
| |
|---|---|
| 二元化合物 |
|
| 三元化合物 |
|
| 四元・五元化合物 |
|
| |
- 表示
- 編集










