DDR2 (белок)
| DDR2 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
 2WUH. 2WUH. | |||||||||||
| Доступные структуры | |||||||||||
| PDB | Поиск ортологов: PDBe, RCSB | ||||||||||
Список идентификаторов PDB 2WUH, 2Z4F | |||||||||||
| Идентификаторы | |||||||||||
| Символ | DDR2 ; MIG20a; NTRKR3; TKT; TYRO10 | ||||||||||
| Внешние ID | OMIM: 191311 MGI: 1345277 HomoloGene: 68505 ChEMBL: 5122 GeneCards: Ген DDR2 | ||||||||||
| номер EC | 2.7.10.1 | ||||||||||
| |||||||||||
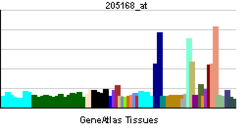
| Профиль экспрессии РНК | |||||||||||
 | |||||||||||
| Больше информации | |||||||||||
| Ортологи | |||||||||||
| Вид | Человек | Мышь | |||||||||
| Entrez | 4921 | 18214 | |||||||||
| Ensembl | ENSG00000162733 | ENSMUSG00000026674 | |||||||||
| UniProt | Q16832 | Q62371 | |||||||||
| RefSeq (мРНК) | NM_001014796 | NM_022563 | |||||||||
| RefSeq (белок) | NP_001014796 | NP_072075 | |||||||||
| Локус (UCSC) | Chr 1: 162.6 – 162.76 Mb | Chr 1: 169.97 – 170.11 Mb | |||||||||
| Поиск в PubMed | Искать | Искать | |||||||||
DDR2 (англ. discoidin domain receptor tyrosine kinase 2; CD167b, КФ 2.7.10.1) — мембранный белок, фермент из надсемейства рецепторных тирозинкиназ, продукт гена DDR2.
DDR2 входит в группу рецепторов, которые содержат домен, гомологичный белку дискоидин 1 из Dictyostelium discoideum. Рецептор коллагена внеклеточного матрикса.
Функции
Рецепторная тирозинкиназа DDR2 функционирует как поверхностный рецептор фибриллярного коллагена, регулирует клеточную дифференцировку, ремоделирование внеклеточного матрикса, клеточную миграцию и пролиферацию. Необходима для нормального развития костной ткани. Регулирует дифференцировку остеобластов и миграцию хондроцитов через сигнальный путь с участием MAP-киназ, который активирует фактор транскрипции RUNX2. Регулирует перестройку внеклеточного матрикса, опосредованного коллагеназами MMP1, MMP2 и MMP13, что облегчает клеточную миграцию, а также инвазивность опухолевых клеток. Участвует в заживлении ран кожных покровов, ускоряя миграцию и пролиферацию фибробластов.[1]
Структура
DDR2 — крупный белок, состоит из 834 аминокислоты, молекулярная масса белковой части — 96,7 кДа. N-концевой участок (378 аминокислот) является внеклеточным, далее расположен единственный трансмембранный фрагмент и внутриклеточный фрагмент (434 аминокислоты). Внеклеточный фрагмент включает до 4 участков N-гликозилирования. Цитозольный участок включает протеинкиназный домен, участок связывания с АТФ, 2 фосфорилируемых серинов и от 3 до 4 фосфорилируемых Src или аутокатализом тирозинов.
Взаимодействия
Активированный DDR2 взаимодействует с адаптерным белком SHC1.[2]
Каталитическая активность
Внутриклеточный протеинкиназный домен фосфорилирует собственные остатки тирозина, перенося фосфатную группу с АТФ на гидроксильную группу аминокислоты. Фермент находится в неактивном состоянии без взаимодействия с коллагенами и фосфорилирования киназой SRC, которые необходимы для активации каталитической активности DDR2.
Тканевая специфичность
Экспрессирован на остеоцитах, остеобластах, костных клетках. Высокий уровень белка наблюдается в сердце, лёгких, низкий — в мозге, плаценте, печени, скелетных мышцах, поджелудочной железе и почках.
См. также
Примечания
- ↑ Uniprot database entry for CD11a (accession number Q16832) (неопр.). Дата обращения: 18 апреля 2012. Архивировано 24 сентября 2017 года.
- ↑ Ikeda, Kazuo; Wang Li-Hsien, Torres Richard, Zhao Hong, Olaso Elvira, Eng Francis J., Labrador Pablo, Klein Rudiger, Lovett David, Yancopoulos George D., Friedman Scott L., Lin Hsin Chieh. Discoidin domain receptor 2 interacts with Src and Shc following its activation by type I collagen (англ.) // Journal of Biological Chemistry : journal. — United States, 2002. — May (vol. 277, no. 21). — P. 19206—19212. — ISSN 0021-9258. — doi:10.1074/jbc.M201078200. — PMID 11884411.
Библиография
- Farndale R.W., Lisman T., Bihan D., et al. Cell-collagen interactions: the use of peptide Toolkits to investigate collagen-receptor interactions (англ.) // Biochemical Society Transactions[англ.] : journal. — 2008. — April (vol. 36, no. Pt 2). — P. 241—250. — doi:10.1042/BST0360241. — PMID 18363567.
- Vogel W. Discoidin domain receptors: structural relations and functional implications (англ.) // The FASEB Journal[англ.] : journal. — Federation of American Societies for Experimental Biology[англ.], 1999. — Vol. 13 Suppl. — P. S77—82. — PMID 10352148.







